|
VAN KRUID
tot MEDICIJN
MEDICIJNEN STEEDS VEILIGER?
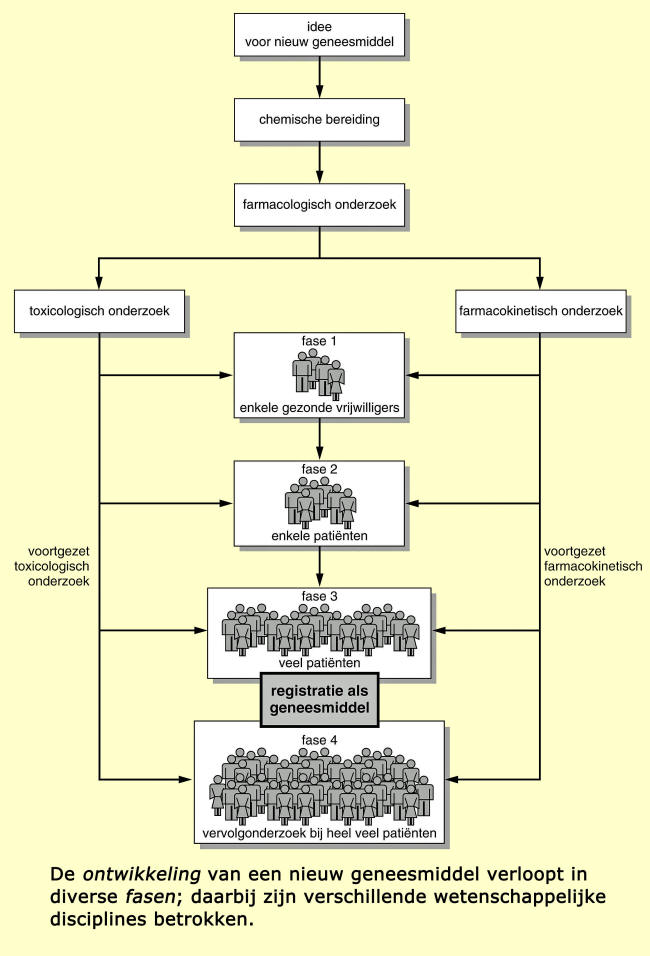
Men denkt nogal eens dat een nieuw medicijn bij toeval door een
verstrooide professor wordt ontdekt. Zo is penicilline werkelijk ontdekt
door ‘gestrooi’ met petrischaaltjes (schaaltjes waarin bacteriën worden
gekweekt). In werkelijkheid speelt het toeval tegenwoordig nog maar een beperkte
rol. Vele deskundigen zoeken jarenlang gericht naar een bepaalde stof waarvan
men de geneeskrachtige werking bij een bepaalde ziekte vermoedt. Voordat deze
stof werkelijk als geneesmiddel op de markt mag worden gebracht, moeten talloze
ontwikkelingsfasen worden doorlopen.
Vele proeven
zijn nodig
Na de chemische bereiding van de stof worden de eerste farmacologische proeven
gedaan met kleine proefdieren (muizen, ratten en cavia’s) of met organen van
deze dieren. Blijkt de stof de verwachte eigenschappen werkelijk te bezitten,
dan wordt het onderzoek voortgezet met grotere proefdieren zoals konijnen en
honden, en soms ook met apen.
Verloopt alles tot zover naar wens, dan is de grote vraag: is de stof ook veilig
voor mensen? Veroorzaakt ze geen kanker? Beschadigt ze geen weefsels of organen?
Heeft ze geen nadelig effect op de voortplanting? En leidt ze niet tot
aangeboren afwijkingen bij ongeboren kinderen? Deze belangrijke vragen moeten
natuurlijk beantwoord worden voordat er proeven met mensen kunnen worden gedaan!
Daarom onderzoekt men eerst de giftigheid met de zogenoemde
toxicologische tests. Zijn de resultaten daarvan bevredigend, dan worden de
eerste proeven met vrijwilligers gestart (fase 1). In deze fase kijkt men vooral
naar de snelheid waarmee het middel wordt opgenomen en in de weefsels en organen
wordt verdeeld, maar ook hoe snel het middel wordt afgebroken of uitgescheiden.
Dit noemt men het farmacokinetische onderzoek. Wordt in deze fase bij de
vrijwilligers ook maar het geringste effect gezien dat niet aanvaardbaar is, dan
wordt het onderzoek stopgezet. Wordt de stof door de vrijwilligers echter goed
verdragen, dan begint men aan de volgende fase.
De eerste patiënten
In fase 2 wordt voor het eerst – onder zeer strenge controle – een klein aantal
patiënten, dat daarvoor in aanmerking komt, met het nieuwe middel behandeld.
Uiteraard wordt hiervoor aan de patiënten eerst toestemming gevraagd. Voordat de
volgende fase van start gaat, worden ook in het laboratorium nog veel
onderzoeken uitgevoerd naar giftigheid en snelheid van opname, omzetting en
uitscheiding van het middel. Pas in fase 3 zijn veel meer patiënten bij het
onderzoek betrokken.
Zijn deze eerste drie fasen met succes afgesloten, dan worden de gegevens
verzameld in een zogenoemd registratiedossier. Dit dossier bevat ook
informatie over de wijze waarop het middel in het bloed kan worden aangetoond en
de manier waarop de toedieningsvorm wordt bereid. Het dossier van één
geneesmiddel kan wel zo’n 40.000 bladzijden met onderzoeksgegevens bevatten.
Nooit meer Softenondrama’s?
Vanaf de eerste chemische bereiding van de stof zijn dan zo’n acht à tien jaar
verstreken. Het dossier wordt vervolgens aan de overheid aangeboden met het
verzoek het geneesmiddel voor ‘praktische toepassing’ in Nederland toe te laten.
Deze enorme berg gegevens wordt dan bestudeerd door het College ter
Beoordeling van Geneesmiddelen. Vanaf 1995 worden nieuwe geneesmiddelen ook
in Europees verband geregistreerd. Dat houdt in dat als het nieuwe middel aan de
(strenge) registratie-eisen van een bepaald land binnen de Europese Unie
voldoet, het in principe ook in de andere lidstaten is geregistreerd.
Sinds de jaren zestig van de vorige eeuw zijn de beoordelingsnormen van het
college steeds strenger geworden. De oorzaak daarvan was mede het
Softenon-drama. Het bleek namelijk dat door het gebruik van het slaapmiddel
Softenon® (thalidomide) door zwangere moeders er zo’n tienduizend vreselijk
verminkte baby’s waren geboren (zie ook 'Onveilige medicijnen' in de
sectie 'Bijwerkingen'). Het middel bleek
onvoldoende te zijn getest! Als het advies van het college positief is, wordt het
geneesmiddel voor praktische toepassing vrijgegeven. De zaak is daarmee echter
niet afgedaan. Het middel wordt in de praktijk voortdurend gecontroleerd. Aan
alle artsen en apothekers wordt gevraagd vermoedelijke bijwerkingen van het
nieuwe product te melden bij het Nederlands Bijwerkingen Centrum LAREB (dit staat voor Landelijke
Registratie Evaluatie Bijwerkingen). Regelmatig wordt ook in de medische
vakbladen melding gemaakt van bijwerkingen. Ook al wordt het middel dus
op grote schaal als ‘geregistreerd geneesmiddel’ toegepast (fase 4), dan
nog bestaat de kans dat er zulke ernstige bijwerkingen aan het licht komen dat
verder gebruik wordt beperkt of zelfs helemaal wordt verboden. Rampen zoals met
Softenon® zijn tegenwoordig echter zeer onwaarschijnlijk. Van de vele stoffen
die als geneesmiddel worden onderzocht, halen door deze strenge eisen slechts
weinige de eindstreep. In de verschillende onderzoeksfasen vallen veel stoffen
af. Geschat wordt dat slechts één op de duizend onderzochte middelen
uiteindelijk op de markt komt. Door deze strenge maatregelen zijn er steeds
betere en vooral veiliger geneesmiddelen in de apotheek verkrijgbaar.

Terug
|
